Calcium, ein lebensnotwendiges Mineral, spielt in unserem Körper zahlreiche zentrale Rollen. Doch sorgt es wirklich für festere Knochen, wie viele glauben? Hier erfährst du, wofür unser Körper Calcium braucht, wie wir es optimal zu uns nehmen und welche Konsequenzen ein Mangel mit sich bringt.
- Calcium, ein essenzieller Mineralstoff, muss in ausreichender Menge in unserem Körper vorhanden sein.
- Es ist bekannt für seine Rolle in der Gesundheit von Knochen und Zähnen, spielt aber auch eine Rolle für unsere Muskeln und die Blutgerinnung.
- Ein Mangel an Calcium kann ernste Auswirkungen haben, insbesondere in Kombination mit einem Vitamin-D-Mangel.
Calcium im Überblick
Calcium, oder eingedeutscht Kalzium, zählt zu den häufigsten Elementen auf der Erde und macht etwa ein Kilo unseres Körpergewichts aus. Dennoch muss man es täglich über die Ernährung zu sich nehmen, um Mangelerscheinungen vorzubeugen. Es ist vor allem in Milchprodukten und pflanzlichen Lebensmitteln enthalten.
Unser Körper speichert 99 Prozent seines Calciums in Zähnen und Knochen. Ein kleinerer Anteil befindet sich außerhalb der Zellen, beispielsweise im Blutplasma. Daher assoziieren es viele Menschen mit gesunden Knochen und einen Mangel mit einer verringerten Knochendichte. Doch der Zusammenhang ist komplexer!
Neben der Knochen- und Zahngesundheit benötigen auch unsere Nerven, Muskeln und der Energiestoffwechsel Calcium. Es ist somit klar, dass es für eine Vielzahl von Funktionen unverzichtbar ist!
Wirkung und Aufgaben
Calcium übernimmt im Körper viele essenzielle Rollen – nicht nur für die Gesundheit der Knochen, wofür es allgemein bekannt ist. Diverse Bereiche unseres Organismus sind auf den Mineralstoff angewiesen:
Es spielt eine zentrale Rolle bei der Mineralisierung von Knochen, Zähnen und im Gewebe. Unsere Körperstrukturen dienen als Calcium-Reservoir und speichern oder geben diesen Mineralstoff je nach Bedarf ab. Im Blut sollte die Konzentration konstant bei einem Prozent liegen, da ein Ungleichgewicht zu Funktionsstörungen führen kann. Um diese Konzentration aufrechtzuerhalten, greift der Körper auf verschiedene Mechanismen zurück.
Dank der Speicherfunktion stellt eine kurzfristige Unterversorgung selten ein erkennbares Problem dar. Doch ein anhaltender Mangel kann dramatische Auswirkungen haben: Zähne und Knochen entkalken, weil der Körper das Mineral abzieht, um die Blutkonzentration zu stabilisieren.
Bei der Speicherung und Regulation helfen zwei spezifische Zelltypen:
Osteoblasten verantworten den Aufbau des Knochenmaterials „Hydroxylapatit“, welches etwa 40 Prozent der Knochenmasse und 95 Prozent des Zahnschmelzes ausmacht.
Osteoklasten übernehmen den Abbau von Knochenmaterial, falls das Blut mehr Kalzium, auch „Serumcalcium“ genannt, benötigt. Ein gesundes Gleichgewicht erfordert die gezielte Unterstützung der aufbauenden Osteoblasten. Mit den richtigen Mitteln können wir ihre Bildung fördern und so brüchigen Knochen effektiv vorbeugen.
Säure-Basen-Gleichgewicht
Da unser Organismus das Calcium im Blut streng reguliert, entnimmt er es bei abnehmender Blutkonzentration aus den Knochen. Auch bei einem sinkenden pH-Wert verwendet der Körper Ca, um übermäßige Säuren auszugleichen.
Eine Übersäuerung des Körpers intensiviert die Bildung von Osteoklasten und somit den Knochenabbau. Zugleich hemmt sie die Entstehung von Osteoblasten, den aufbauenden Zellen. Bei einem basischen Blut-pH-Wert (Alkalose) hingegen erhöht sich die Produktion der aufbauenden Zellen (2 – 5).
Stress oder eine Ernährung reich an Salz, Zucker, Weißmehl, Alkohol oder tierischen Produkten kann zu einer Übersäuerung führen. Um den Säureüberschuss auszugleichen, verwendet der Körper hauptsächlich zwei Mineralien: Bicarbonat und Calcium aus den Knochen, unserem größten Basenreservoir (6). So spielt es eine zentrale Rolle im Säure-Basen-Gleichgewicht.
Leider ist die Ernährung im globalen Westen reich an Lebensmitteln, die unser Körper sauer verstoffwechselt. Sie erhöhen den Bedarf an Mineralien und können somit zu einem erhöhten Knochenabbau beitragen. Um dem entgegenzuwirken, sollten wir auf eine ausgewogene, pflanzenbasierte Ernährung zurückgreifen und den Konsum von Zucker, tierischen Produkten und Alkohol minimieren.
Funktion von Calcium in Muskeln und Nerven
Kalzium, als positiv geladenes Ion, leitet Signale weiter und erhält somit Funktionen von Muskeln, Nerven und Zellen aufrecht. Es interagiert mit denselben Neurotransmitter-Strukturen wie Magnesium. Dabei agiert Magnesium entspannend, während Calcium für die Muskelkontraktion sorgt.
Fließt Calcium in die Muskeln, ziehen sich diese zusammen. Bei einem Calciummangel vermindert sich dieser Prozess, was zu Muskelkrämpfen oder Zittern führen kann.
Ein Übermaß an Calcium, wie bei einer Überdosierung, kann ebenfalls zu Zuckungen oder Krämpfen führen. Solche Krämpfe kennen wir von unseren Armen oder Beinen, wo sie unangenehm und störend sind. Doch sie könnten auch Atem- oder Herzmuskulatur betreffen, die wir nicht willentlich steuern! Dies kann gravierende Folgen haben!
Calcium und die Blutgerinnung
Calcium spielt eine zentrale Rolle bei der Blutgerinnung: Es aktiviert Hormone, Enzyme und Proteine, die entscheidend für die Blutgerinnung sind. Beispielsweise ist es an der Transformation von Prothrombin in seine aktive Form Thrombin beteiligt.
Ein Gleichgewicht der Gerinnungsfaktoren ist essenziell: Bei Blutungen soll die Gerinnung den Blutfluss stoppen. Doch eine übermäßige oder pathologische Gerinnung wie bei einer Thrombose kann die Blutgefäße verstopfen!
Das Risiko für innere Blutgerinnsel in den Gefäßen steigt bei Frauen, die Verhütungspillen verwenden. Auch Faktoren wie starkes Übergewicht, fehlende Bewegung oder Rauchen erhöhen die Thrombose-Gefahr (7).
Calcium beeinflusst durch seine Wirkung auf Hormone und Blutgerinnung Menstruationsbeschwerden und das prämenstruelle Syndrom positiv. Das ergab eine Studie mit 66 jungen Frauen (8).
Die Probandinnen erlebten bei Calciumzufuhr weniger emotionale Beschwerden. Forscher glauben, dass ein ausgewogener Mineralstoffhaushalt den Menstruationszyklus unterstützt.
Doch auch negative Auswirkungen bei hohen Calciumwerten existieren: Eine 2016er-Studie (9) mit 1507 Männern über drei Jahre hinweg fand eine verringerte Flexibilität der Blutgefäße bei zu hohem Calciumgehalt im Blut, was arterielle Steifigkeit fördert.
In den Zellen
Durch die Stimulation von Proteinen übernimmt Calcium wichtige Aufgaben für unsere Zellen. Hierzu gehören Proteine wie der Adenosyl-Ribosylierungs-Faktor (“ARF”) und Synaptotagmin. Letzteres ist am Vestikeltransport beteiligt, durch den Botenstoffe an ihr Ziel kommen.
In den Zellen kontrollieren und speichern Bindeproteine wie Calmodulin Calcium und setzen es bei Bedarf frei. Sie beeinflussen zahlreiche Zellfunktionen, beispielsweise die Produktion von Fettsäuren, Glykogen oder Cholesterin. Als positiv geladenes Ion erfüllt Ca in fast allen Zellen wesentliche Funktionen.
Calciumabsorption und Verdauung
Der Darm teilt sich in Bereiche mit unterschiedlichen Funktionen bei der Nährstoffabsorption. Das Duodenum, etwa 30 cm nach der Magenöffnung, ist speziell für die Aufnahme von Kalzium verantwortlich. Es nimmt Calcium mit einer Rate von 20 bis 60 Prozent auf, abhängig von der zugeführten Menge.
Diese stark variierenden Prozentzahlen resultieren aus den zwei Transportwegen für die Absorption aus dem Darm: Bei geringer Zufuhr oder Calciummangel absorbiert der Körper die maximal mögliche Menge.
Hierbei spielen die aktiven Transporter “TRPV” eine Rolle, die allerdings schnell gesättigt und nur begrenzt vorhanden sind. Bei höheren Mengen reduziert sich deshalb die Aufnahmerate.
Erstaunlicherweise kann Vitamin D die Bildung dieser Transporter fürCalcium stimulieren. Bei guter Vitamin-D-Versorgung steigt also auch die Absorption, und zusätzliche Osteoblasten entstehen, die beim Knochenaufbau helfen.
Demnach benötigen wir auch Vitamin D, um die Knochen zu stabilisieren. Fehlt das Vitamin, sinkt auch die Calciumabsorption, und in schweren Fällen kann ein Mangel entstehen, da die notwendigen Transporter nicht vorhanden sind. Eine unzureichende Zufuhr resultiert in brüchigen Knochen.
Eine erhöhte Ca-Aufnahme allein stärkt also nicht automatisch die Knochen; auch Faktoren wie die Vitamin-D-Zufuhr sind entscheidend. (11, 12)
Effektive und gestörte Calciumabsorption
Für eine effiziente Calciumabsorption brauchen wir Magensäure. Bei eingeschränkter Magensäureproduktion, etwa durch Medikamente oder Magenerkrankungen, nimmt die Calciumabsorption ab.
Forscher analysierten die Calciumabsorption bei Gastritis-Patienten und fanden heraus, dass unser Körper Calciumcarbonat, wie es in Sangokoralle vorkommt, besonders gut resorbiert, wenn man es mit einer Mahlzeit zu sich nimmt. Auch Calciumcitrat und Milchkalzium verbessern die Calciumabsorption bei dieser Krankheit. (13, 14)
Nierenprobleme oder Schilddrüsenüberfunktion können zu vermehrter Kalziumausscheidung mit dem Urin führen. Dieser Verlust stört den Mineralstoffhaushalt und kann langfristig zu Mangelerscheinungen führen.
In solchen Fällen könnte die Einnahme von Vitamin D, Calcium, Magnesium und Vitamin K2 zusammen mit einer phosphatarmen Diät hilfreich sein. (15-17)
Eine indische Studie (19) zeigte, dass nicht alle Calciumformen gleich effektiv sind. Forscher maßen die Bioverfügbarkeit und den Anstieg des Calciumspiegels im Blut nach Einnahme von fünf verschiedenen Formen:
Ca-Carbonat aus der Sangokoralle mit 500 mg
Ca-Carbonat aus der Sangokoralle mit 225 mg
Ca-Carbonat, das nicht aus der Sangokoralle gewonnen wurde, mit 500 mg
Ca-Carbonat, das nicht aus der Sangokoralle gewonnen wurde, mit 400 mg
Ca-Citrat, das nicht aus der Sangokoralle gewonnen wurde, mit 250 mg
Die Sangokoralle verbesserte die Absorption schon bei niedrigeren Dosierungen signifikant.
Von den getesteten Formen zeigte die Sangokoralle die beste Wirkung. Schon 225 mg steigerten den Calciumspiegel signifikant mehr als Produkte ohne Korallenursprung. Selbst bei höherer Dosierung konnten die Alternativformen den Effekt der Sangokoralle nicht nachahmen!
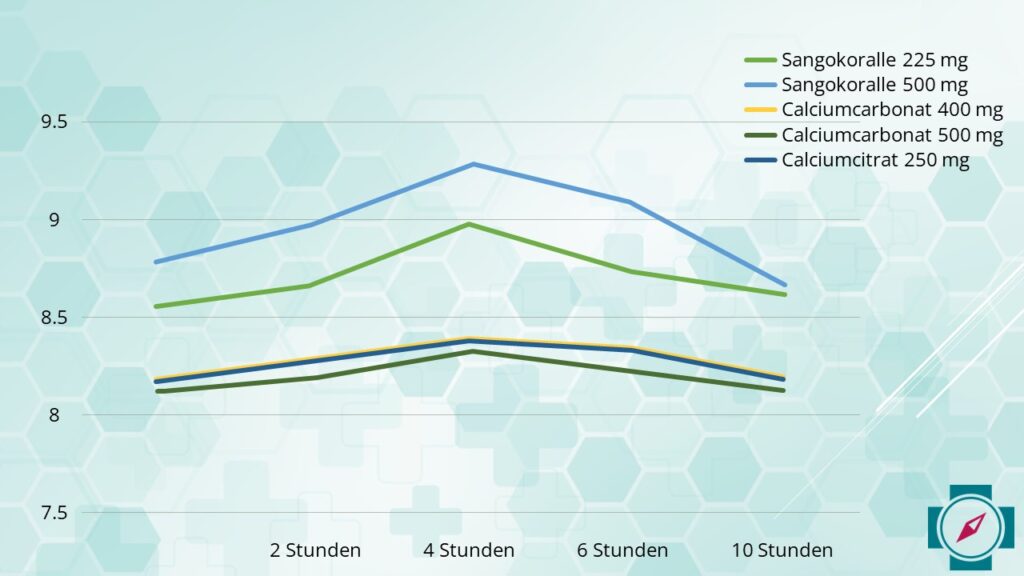
Die Ergebnisse der Studie aus Indien zeigen, dass die Sangokoralle schon bei geringeren Dosierungen zu einer besseren Calciumaufnahme führt.
Eine japanische Studie (18) bestätigte, dass die Sangokoralle eine überlegene Calciumquelle darstellt. Teilnehmer, die Kekse mit 525 mg Calcium aus der Sangokoralle konsumierten, absorbierten signifikant mehr Calcium als diejenigen, die Calciumcarbonat erhielten.
Produkte aus der Sangokoralle liefern auch Magnesium im idealen Verhältnis. Allerdings reichern nicht alle Korallen genug Magnesium an, weshalb man beim Kauf von Präparaten auf Qualität achten sollte.
Neben der Sangokoralle können auch andere Verbindungen zu einer besseren Versorgung beitragen. Ca-Citrat erwies sich ebenfalls als gut bioverfügbar. Es war etwa 20 Prozent effektiver als Calciumcarbonat. Eine dritte in dieser Untersuchung eingesetzte Form, Ca-Formiat, toppte den Effekt der anderen beiden Verbindungen noch deutlich und wies mit Abstand die beste Bioverfügbarkeit auf (20).
Neben der Form beeinflusst auch unsere Ernährung die Aufnahmerate. Ballaststoffreiches Gemüse etwa verlängert die Verdauungszeit, was die Calciumabsorption verbessert. Vitamin C, Essig und andere organische Säuren können diesen Prozess weiter verstärken.
Dagegen beeinträchtigen Phytinsäure oder koffeinhaltige Getränke wie Kaffee und Kakao die Aufnahme negativ. Ein Kaffee zu den Mahlzeiten kann die Aufnahme vieler Mineralien und B-Vitamine hemmen. (21, 22)
Magnesium- und Calciumabsorption aus Trinkwasser
Trinkwasser dient als eine zusätzliche Quelle für Kalzium. Unser Körper kann das in Wasser gelöste Magnesium und Calcium problemlos aufnehmen. Die gelöste Form dieser Mineralien bietet eine hohe Bioverfügbarkeit, doch die maximale Menge ist begrenzt, da man nur eine bestimmte Wassermenge pro Tag zu sich nimmt. Zudem schwankt der Mineralstoffgehalt in Trinkwasser sehr stark.
Die Wasserhärte ergibt sich aus dem Gehalt von Calcium und Magnesium im Wasser. Bei hartem Wasser, das viel von den Mineralstoffen enthält, treten vermehrt Kalkablagerungen in Leitungen und Küchengeräten auf.
Obwohl hohe Werte dieser Mineralien im Haushaltswasser zusätzliche Aufwände verursachen können, profitieren die Bewohner von den darin gelösten Mineralstoffen. Daher hat man frühere Grenzwerte für Calcium im Trinkwasser revidiert.
Calciumaufnahme und beeinflussende Faktoren
Nahrungsinhaltsstoffe und deren Verarbeitung beeinflussen die Aufnahme von Kalzium. Zum Beispiel hemmt Phytinsäure aus Nüssen, Samen und Hülsenfrüchten die Absorption von Mineralstoffen.
Doch Maßnahmen wie Einweichen, Keimung oder Fermentation können diese hemmende Wirkung stark mindern. Dabei bauen enzymatische Prozesse die Phytinsäure ab und verringern so deren Einfluss auf die Calciumabsorption.
Bei der Brotherstellung sorgt die Sauerteiggährung für den Abbau von Phytinsäure, wodurch das Brot besser verdaulich wird. (23)
Oxalsäure stört ebenfalls die Mineralstoffabsorption und kommt besonders in Spinat, Mangold, Roter Beete, Nüssen, Kakao, Kaffee und schwarzem Tee vor. Deshalb sollte man diese Lebensmittel getrennt von mineralstoffreicher Kost konsumieren, um die Aufnahme von Calcium nicht zu stören. (24)
Sowohl Oxal- als auch Phytinsäure bilden mit Mineralstoffen wie Calcium, Eisen und Magnesium schwer lösliche Verbindungen, die unser Körper kaum resorbieren kann. Man bezeichnet sie deswegen auch als “Mineralstoffräuber”. Ballaststoffe (Zellulose) können zwar auch Mineralstoffe binden, doch da sie die Verdauungszeit im Darm verlängern, haben sie insgesamt einen positiven Effekt.
Bestimmte Medikamente, beispielsweise Magentabletten oder die Antibaby-Pille, können die Aufnahme von Calcium und anderen Mineralstoffen stören. Bei Calciummangel sollte man einen Arzt aufsuchen, um Lösungsansätze zu besprechen.
Calcium Tagesdosis und vorkommen in Lebensmitteln
Die empfohlene Calcium Tagesdosis laut Deutscher Gesellschaft für Ernährung DGE variiert mit dem Lebensalter. Heranwachsende haben dabei generell einen deutlich größeren Bedarf, da sie das Calcium für den Knochenaufbau benötigen.(25)
| Alter | mg/Tag |
| 0-4 Monate | 220 |
| 4-12 Monate | 330 |
| 1-4 Jahre | 600 |
| 4-7 Jahre | 750 |
| 7-10 Jahre | 900 |
| 10-13 Jahre | 1100 |
| 13-19 Jahre | 1200 |
| Ab 19 Jahren | 1000 |
Dass Milch und Milchprodukte reich an Calcium sind, ist bekannt. Oftmals übersieht man jedoch, dass auch viele pflanzliche Lebensmittel erhebliche Mengen aufweisen. Ein bedeutender Vorteil der pflanzlichen Quellen liegt im meist ausgewogeneren Verhältnis von Calcium zu Magnesium.
Kuhmilch weist beispielsweise ein Verhältnis von 12 zu 1 (Ca zu Mg) auf, während Brokkoli ein günstigeres 3 zu 1-Verhältnis bietet. Bei Mozzarella liegt das Verhältnis sogar bei bis zu 38 zu 1!
Muttermilch, reich an Kalzium, zeigt ein Verhältnis von 10:1 (Ca zu Mg). Sie enthält im Vergleich zu Milch von Kühen, Schafen oder Ziegen weniger Kalium und Phosphat. Diese Mineralien beeinflussen zusammen mit Kalzium und Magnesium den Calciumstoffwechsel und die Aufnahme.
Menschen, die häufig Milchprodukte konsumieren, könnten durch eine Magnesiumergänzung das unausgewogene Verhältnis zu Calcium korrigieren und so einem Magnesiummangel entgegenwirken.
In einigen Nahrungsmitteln, wie Pflanzenmilch, entdeckt man auch die Alge „Lithothamnium calcareum“. Sie steigert zwar den Calciumgehalt der jeweiligen Produkte, enthält aber wenig Magnesium, was einen Magnesiummangel begünstigt und damit die Calciumaufnahmerate beeinträchtigen könnte.
Bei einer ausgewogenen pflanzlichen Ernährung, die calciumhaltige Lebensmittel einschließt, sollte ein Mangel beider Nährstoffe kein Problem darstellen. (26)
| Lebensmittel | mg/100g (Ca:Mg) |
| Kuhmilch 3,5% | 12:1 |
| Käse | 95-1375:8-45 |
| Brokkoli | 3:1 |
| Löwenzahnblätter | 170:37 |
| Grünkohl | 210:30 |
| Rucola | 160:35 |
| Bohnen | 25-115:45-150 |
| Paranuss | 13:16 |
| Pistazien | 135:160 |
| Haselnuss | 225:160 |
| Mohn | 1460:330 |
| Sesam | 780:350 |
| Oliven | 95-150:20 |
| Quinoa | 80:275 |
| Tofu | 9:10 |
| Leinsamen | 200:325 |
| Haferflocken | 45:130 |
| Roggenbrötchen | 120:40 |
| Pastinake | 2:1 |
Unser Körper absorbiert nur rund 30 Prozent des in der Nahrung enthaltenen Calciums, um seinen Tagesbedarf zu decken. Wie viel er aufnimmt, hängt von der Nahrungszusammensetzung ab. Mit geeigneten Lebensmitteln und Ergänzungsmitteln kann man die Aufnahmerate erhöhen:
– Sauerteig bevorzugen
– Organische Säuren wie Vitamin C, Zitronensäure und Essigsäure einnehmen
– Vitamine D, K2 und Magnesium zu sich nehmen
– Kaffee, Tee und Kakao um Mahlzeiten herum vermeiden
– Calciumhaltige pflanzliche Lebensmittel regelmäßig essen, Spinat und Mangold jedoch nicht täglich
– Nüsse, Samen und Hülsenfrüchte einweichen oder keimen lassen
– Eine natrium- und phosphatreiche Ernährung meiden
– Regelmäßig bewegen
– Mineralstoffreiches Wasser, z.B. von Sangokoralle, trinken
Ist Milch eine gute Quelle?
Viele glauben, Calcium aus Milch und Milchprodukten stärke die Knochen. Doch schon 1966 entdeckten Wissenschaftler das „Calciumparadoxon“: Osteoporose tritt besonders in Ländern mit vielen Milchprodukten und viel Calcium in der Ernährung auf. Hier sieht man auch vermehrt kalkhaltige Nierensteine und Arterienverkalkungen.
In Deutschland leiden zwischen sechs und acht Millionen Menschen an Osteoporose. Diese „stark poröse Knochenmatrix“ erhöht das Risiko von Knochenbrüchen. Ab 30 Jahren verringert sich die Knochendichte stetig.
Besonders postmenopausale Frauen sind gefährdet, da mit dem Einsatz der Wechseljahre die Konzentration des Hormons Östrogen, welches maßgeblich zur Mineralisierung der Knochen beiträgt, stark abnimmt.
Obwohl unsere durchschnittliche Ernährung viel Calcium enthält, sodass ein Mangel unwahrscheinlich erscheint (27-36), verursacht Osteoporose jedes Jahr rund 70.000 Knochenbrüche. Die Ursache hierfür ist weniger eine unzureichende Zufuhr, als die ungünstigen Bedingungen für seine Verwendung im Körper.

Das richtige Verhältnis zwischen Calcium und Magnesium
Obgleich unsere Nahrung größtenteils genügend Kalzium bietet, trifft man oft auf einen Mangel (1). Ein intensiverer Knochenaufbau oder Reminalisierung erfordert jedoch nicht zwingend mehr Calcium.
Möchte man besonders viel Calcium zuführen, raten viele zu Milchprodukten oder angereicherten Lebensmitteln. Doch oft liefern diese nicht das benötigte Magnesium. Ausreichend Magnesium ist für die Aufnahme und Verstoffwechslung von Calcium im Körper unbedingt erforderlich.
Die Sangokoralle bietet ein ideales Ca-Mg-Verhältnis von 2:1. Regionen, in denen Menschen besonders alt werden, haben oft eines gemeinsam: Sie konsumieren Wasser, das reich an Calcium und Magnesium ist. Die japanische Insel Okinawa ist für ihre vielen, über 100-jährigen Bewohner bekannt.
Niedrige Kalorienzufuhr, viel Bewegung und soziale Kontakte im Freien tragen zur Langlebigkeit bei, doch das Wasser spielt eine zentrale Rolle. Es durchfließt Korallenriffe, in denen die Sangokoralle vorkommt. Diese Koralle besitzt Calcium und Magnesium im Verhältnis 2:1 und gibt diese ins Wasser ab.
Das resultiert in einer hohen Bioverfügbarkeit des Mineralstoffs, wodurch sich die Aufnahmerate verbessert. Wegen ihrer herausragenden Qualität als Kalziumquelle erfreuen sich Produkte aus Sangokoralle großer Beliebtheit. Dabei schützt man die Korallen und nutzt nur natürlich abgetragene Teile, weshalb der Konsum ethisch vertretbar bleibt.
Der Darm reguliert die Calciumaufnahme, sodass eine Überdosis selten ist. In Okinawa sind trotz calciumreichem Trinkwasser keine Nebenwirkungen bekannt.
Außerhalb Japans löst man Sangokorallenpulver in Trinkwasser auf. Dieses Wasser bietet Ca und Mg im Verhältnis 2:1. Der Verzehr über den Tag verteilt fördert eine optimale Aufnahme und Verwertung.
Calciummangel
Für robustes Knochengewebe benötigen wir Calcium und Phosphat. Da unser Körper die Mineralstoffe nicht selbst erzeugt, müssen wir sie über die Nahrung zuführen. Allerdings reicht die bloße Zufuhr über Lebensmittel nicht: Der Darm muss die Substanzen absorbieren, bevor sie unsere Knochen stärken.
Oft liegt die Hauptursache für Mangel nicht in einer calciumarmen Ernährung, sondern in einem Vitamin-D-Mangel! Ohne das Sonnenvitamin erfolgt weder eine Calciumaufnahme noch eine Verwendung in Knochen und Zähnen.
Andere Faktoren, die zu Calciummangel beitragen, umfassen:
– Calciumarme Kost
– Hormonelle Ungleichgewichte
– Exzessiver Alkoholkonsum
– Erhöhter Bedarf während Schwangerschaft, Stillzeit oder Pubertät
– Nierenleiden
– Schilddrüsenprobleme
– Verdauungsprobleme
– Entzündungen der Bauchspeicheldrüse
– Intensive sportliche Betätigung
Zu den Symptomen eines Calciummangels gehören:

Die Symptome eines Calciummangels können unspezifisch sein, wodurch die Identifikation eines Mangels schwerfallen kann. Andere Mangelerscheinungen können ähnliche Anzeichen hervorrufen. Bei einem vermuteten Calciummangel kann eine Blut- oder Knochenanalyse im Labor Aufschluss geben.
Calciummangel infolge von Schilddrüsenunterfunktion
Der Calciumhaushalt stellt ein komplexes System dar, welches zahlreiche Funktionen steuert. Bei einem niedrigen Blutcalciumspiegel gibt die Nebenschilddrüse das Hormon PTH frei. Dieses Parathormon hat das Ziel, Calcium aus Darm, Knochen und Niere intensiver ins Blut zu transportieren und so den Blutspiegel zu erhöhen.
Das Parathormon fördert die Bildung von Osteoklasten, welche Calcium von den Knochen ins Blut übertragen. In der Niere beeinflusst PTH ebenfalls die Calcium-Resorption und fördert die Freisetzung von Calcitriol, der aktiven Form von Vitamin-D. Dieses Vitamin agiert als Hormon und steigert die Calciumaufnahme im Darm.
Wenn jedoch das Parathormon nicht in genügender Menge vorhanden ist, erfolgt keine Calciumfreisetzung aus den Knochen und keine Resorption aus dem Urin. Das Resultat kann ein Calciummangel sein. Untersuchungen haben ergeben, dass Patienten mit Schilddrüsenunterfunktion oft einen Vitamin-D-Mangel und Calciummangel aufweisen.
Calciummangel verhindern: Analyse des Versorgungsstatus
Da der Calciumspiegel im Körper strikt kontrolliert ist, ändern sich die Serumwerte im Blut hauptsächlich bei extremem Mangelerscheinungen. Ein Bluttest kann daher nur erhebliche Veränderungen anzeigen – eine leichte Unterversorgung kann man daraus hingegen nicht ablesen.
Stattdessen bietet sich eine Untersuchung der Knochenstruktur (mittels DXA- oder QCT-Methode) an. Calcium speichert sich hauptsächlich in den Knochen, wodurch sich frühzeitig Rückschlüsse auf die Versorgung ziehen lassen. Doch meist erfolgt eine solche Untersuchung erst im fortgeschrittenen Alter oder bei bestimmten Verdachtsmomenten.
Manchmal dienen auch Urinproben zur Diagnose eines Mangels oder Überschusses. Durch die Ausscheidungsrate kann man die Menge des aufgenommenen oder zurückbehaltenen Calciums bestimmen. Da jedoch die Absorptionsmengen im Darm variieren, liefert diese Methode oft nur grobe Ergebnisse.
In großen Datenanalysen nutzt man dennoch diese Methode. Aus solchen Studien resultiert eine empfohlene Tageszufuhr von etwa 1.000 mg für Erwachsene. Diese Werte, basierend auf Schätzungen mit Sicherheitszuschlägen, verdienen eine kritische Betrachtung.
Um einen Calciummangel sicher auszuschließen, empfiehlt sich ein Bluttest zur Bestimmung der Zellversorgung. Erhöhte Werte könnten auf Gärungsprozesse und somit auf Übersäuerung hindeuten, die manchmal mit Krebszellbildung in Verbindung gebracht wird. Dieser Wert gibt jedoch kaum Auskunft über die wirkliche Versorgung.
Da jede Messmethode ihre eigenen Schwächen aufweist, bleibt die Diagnose eines Calciummangels schwierig. Es erscheint ratsam, auf Symptome einer Unterversorgung zu achten und die eigene Zufuhr regelmäßig zu überdenken.
Fazit: Calcium für gesunde Knochen und Blutgerinnung
Das essenzielle Element Calcium bildet einen wesentlichen Bestandteil unserer Knochen und Zähne. Erhöhte Mengen im Blut können den Knochenaufbau verstärken. Im Gegensatz dazu führt ein niedriger Blutwert zum Knochenabbau, da der Körper den Mineralstoff entnimmt, um den Blutwert zu stabilisieren.
Ein Mangel tritt auf, wenn die Versorgung über einen längeren Zeitraum nicht ausreichend ist. Trotz einer guten Versorgung durch Nahrungsmittel wie Milchprodukte und pflanzliche Lebensmittel treten Mangelerscheinungen oft auf. Dieses Phänomen, bei dem trotz ausreichender Calciumzufuhr ein Knochenabbau erfolgt, kennt man als „Calciumparadox“.
Ein Grund hierfür liegt darin, dass unser Körper zusätzlich auch andere Elemente wie Magnesium, Vitamin D und Vitamin K2 sowie ausreichend Bewegung benötigt, um den Mineralstoff effektiv zu nutzen.
Da die Symptome eines Calciummangels vielseitig und unspezifisch sind und die Messverfahren nicht immer präzise, erweist sich der Mangel in der Praxis als schwer identifizierbar.
Viele pflanzliche Lebensmittel und Milchprodukte bieten Möglichkeiten zur zusätzlichen Aufnahme. Mineralstoffreiches Trinkwasser, angereichert mit Calcium aus der Sango-Koralle, hat sich als hervorragende Quelle bewährt.
Es bietet Ca und Mag im perfekten Verhältnis von zwei zu eins und eignet sich daher besonders gut für unsere Aufnahme.
Wenn trotz ausreichender Zufuhr Mangelerscheinungen auftreten, könnte eine zusätzliche Einnahme von Magnesium oder Vitamin D ratsam sein. Das Meiden von phosphatreichen Lebensmitteln wie Fertiggerichten und Softdrinks könnte ebenfalls helfen, da diese unseren Mineralstoffhaushalt beeinträchtigen können.
FAQ – Häufig gestellte Fragen zu Calcium und Calciummangel
Calcium sorgt für gesunde, starke Knochen und Zähne. Bei Calciummangel kann es leichter zu Knochenbrüchen kommen. Der Mineralstoff ist auch für die Funktion unserer Muskeln und Nerven sowie die Blutgerinnung von hoher Bedeutung.
Die Aufnahme von ca. 3 Gramm Sangokoralle zeigt die besten Ergebnisse bei der Calciumaufnahme. Das Pulver wird in Wasser aufgelöst und über den Tag verteilt getrunken. Durch sein ideales Verhältnis von Calcium zu Magnesium ist eine ideale Versorgung gegeben.
Der Zeitpunkt der Calciumaufnahme ist weniger wichtig. Du kannst Calcium vor, nach oder mit dem Essen einnehmen. Bei einer Einnahme mit einer Mahlzeit sollte diese jedoch keine hemmenden Faktoren wie Oxal- oder Phytinsäure enthalten. Wichtiger sind Faktoren wie Vitamin-D-Versorgung, Phosphataufnahme und das richtige Verhältnis von Calcium zu Magnesium.
Unser Körper benötigt ausreichend Vitamin D, um das aufgenommene Calcium zu verwenden. Wer nicht genügend Vitamin D erhält (z.B. in den Wintermonaten), kann es gemeinsam mit Calcium einnehmen, um die Knochen zu stärken.
Ein Calciummangel lässt sich nur schwer anhand der Symptome erkennen, da sie auch andere Ursachen haben können. Zu den Symptomen von Calciummangel zählen Muskelkrämpfe, Herz-Kreislaufprobleme, brüchige Fingernägel, Haarausfall, trockene Haut, Verdauungsstörungen, Vergesslichkeit, Osteoporose, Schlafstörungen …
Wer langfristig sehr hohe Mengen Calcium einnimmt, riskiert unter anderem die Bildung von Nierensteinen. Einige Calcium Präparate können Verstopfung, Blähungen, Übelkeit, Magenschmerzen oder Durchfall hervorrufen. Naturprodukte wie die Sangokoralle sind deutlich verträglicher.
Quellenverzeichnis
(1) Nationale Verzehrstudie II, Max Rubner-Institut, Bundesforschungsinstitut für Ernährung und Lebensmittel, 2008
(2) Bushinsky DA: Metabolic alkalosis decreases bone calcium efflux by suppressing osteoclasts and stimulating osteoblasts. Am J Physiol 271: F216–F222, 1996
(3) Bushinsky DA: Stimulated osteoclastic and suppressed osteoblastic activity in metabolic but not respiratory acidosis. Am J Physiol 268: C80–C88, 1995
(4) Bushinsky DA, Parker WR, Alexander KM, Krieger NS: Metabolic, but not respiratory, acidosis increases bone PGE(2) levels and calcium release. Am J Physiol Renal Physiol 281: F1058–F1066, 2001
(5) Krieger NS, Sessler NE, Bushinsky DA: Acidosis inhibits osteoblastic and stimulates osteoclastic activity in vitro. Am J Physiol 262: F442–F448, 1992
(6) Pizzorno, Joseph. “Acidosis: An Old Idea Validated by New Research.” Integrative medicine (Encinitas, Calif.) vol. 14,1 (2015): 8-12.
(7) https://www.hopkinsmedicine.org/health/conditions-and-diseases/thrombosis; aufgerufen am 05.05.2021
(8) Shobeiri F, Araste FE, Ebrahimi R, Jenabi E, Nazari M. Effect of calcium on premenstrual syndrome: A double-blind randomized clinical trial. Obstet Gynecol Sci. 2017 Jan;60(1):100-105. doi: 10.5468/ogs.2017.60.1.100. Epub 2017 Jan 15. PMID: 28217679; PMCID: PMC5313351.
(9) Kimura K, Tomiyama H, Matsumoto C, Odaira M, Shiina K, Nagata M, Yamashina A. Longitudinal changes of the serum calcium levels and accelerated progression of arterial stiffness with age. Atherosclerosis. 2015 Dec;243(2):486-92. doi: 10.1016/j.atherosclerosis.2015.10.002. Epub 2015 Oct 8. PMID: 26520904.
(10) Mackawy, Amal Mohammed Husein et al. “Vitamin d deficiency and its association with thyroid disease.” International journal of health sciences vol. 7,3 (2013): 267-75. doi:10.12816/0006054
(11) Walters JR., Calcium channel TRPV6 expression in human duodenum: different relationships to the vitamin D system and aging in men and women. J Bone Miner Res. 2006 Nov;21(11):1770-7. doi: 10.1359/jbmr.060721. PMID: 17002582.
(12) Zheng W., Critical role of calbindin-D28k in calcium homeostasis revealed by mice lacking both vitamin D receptor and calbindin-D28k. J Biol Chem. 2004 Dec 10;279(50):52406-13. doi: 10.1074/jbc.M405562200. Epub 2004 Sep 29. PMID: 15456794.
(13) Cavalcoli F, Zilli A, Conte D, Massironi S. Micronutrient deficiencies in patients with chronic atrophic autoimmune gastritis: A review. World J Gastroenterol. 2017 Jan 28;23(4):563-572. doi: 10.3748/wjg.v23.i4.563. PMID: 28216963; PMCID: PMC5292330.
(14) Wood RJ, Serfaty-Lacrosniere C. Gastric acidity, atrophic gastritis, and calcium absorption. Nutr Rev. 1992 Feb;50(2):33-40. doi: 10.1111/j.1753-4887.1992.tb02510.x. PMID: 1570081.
(15) Inker LA, Grams ME, Levey AS, et al.; CKD Prognosis Consortium. Relationship of estimated GFR and albuminuria to concurrent laboratory abnormalities: an individual participant data meta-analysis in a global consortium. Am J Kidney Dis. 2019;73(2):206–217. doi:10.1053/j.ajkd.2018.08.013
(16) Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD). Kidney Int Suppl (2011). 2017;7(1):1–59. doi:10.1016/j.kisu.2017.04.001
(17) Isakova T, Nickolas TL, Denburg M, et al. KDOQI US commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD). Am J Kidney Dis. 2017;70(6):737–751. doi:10.1053/j.ajkd.2017.07.019
(18) Ishitani K, Itakura E, Goto S, Esashi T. Calcium absorption from the ingestion of coral-derived calcium by humans. J Nutr Sci Vitaminol (Tokyo). 1999 Oct;45(5):509-17. doi: 10.3177/jnsv.45.509. PMID: 10683804.
(19) Varsha et al., A RANDOMIZED, VOLUNTEER, PHARMACOKINETIC STUDY COMPARING ABSORPTION AND BIOAVAILABILITY OF CORAL CALCIUM WITH CALCIUM CARBONATE AND CALCIUM CITRATE MALATE SUPPLEMENTS, EUROPEAN JOURNAL OF PHARMACEUTICAL AND MEDICAL RESEARCH.5(12):341-345 (2018)
(20) Hanzlik RP, Fowler SC, Fisher DH. Relative bioavailability of calcium from calcium formate, calcium citrate, and calcium carbonate. J Pharmacol Exp Ther. 2005 Jun;313(3):1217-22. doi: 10.1124/jpet.104.081893. Epub 2005 Feb 25. PMID: 15734899.
(21) Zijp IM, Korver O, Tijburg LB. Effect of tea and other dietary factors on iron absorption. Crit Rev Food Sci Nutr. 2000 Sep;40(5):371-98. doi: 10.1080/10408690091189194. PMID: 11029010.
(22) Tsedeke Wolde, Effects of caffeine on health and nutrition: A Review. Food Science and Quality Management. Vol. 30, 2014
(23) Gupta, Raj Kishor et al. “Reduction of phytic acid and enhancement of bioavailable micronutrients in food grains.” Journal of food science and technology vol. 52,2 (2015): 676-84. doi:10.1007/s13197-013-0978-y
(24) Kelsay JL. Effects of fiber, phytic acid, and oxalic acid in the diet on mineral bioavailability. Am J Gastroenterol. 1987 Oct;82(10):983-6. PMID: 2821800.
(25) Deutsche Gesellschaft für Ernährung et al.: Referenzwerte für die Nährstoffzufuhr, 2. Auflage, 3. aktualisierte Ausgabe (2017)
(26) Deutsche Gesellschaft für Ernährung et al., Die Nährwerttabelle,6 aktualisierte Auflage, 3 (2019/2020)
(27) Aside from nutritional values of milk and dairy products their biologically active compounds (bioactive peptides, probiotic bacteria, antioxidants, vitamins, specific proteins, oligosaccharides, organic acids, highly absorbable calcium, conjugated linoleic acid and others) have crucial impacts on human functioning and health [1,25,38,39,40,41,42,43,44].
(28) Park Y.W. Introduction: Overview of bioactive components in milk and dairy products. In: Park Y.W., editor. Bioactive Components in Milk and Dairy Products. Publishers, Wiley- Blackwell; Ames, Iowa: Oxford, UK: 2009. pp. 3–14.
(29) Guo J., Astrup A., Lovegrove J.A., Gijsbers L., Givens D.I., Soedamah-Muthu S.S. Milk and dairy consumption and risk of cardiovascular diseases and all-cause mortality: Dose–response meta-analysis of prospective cohort studies. Eur. J. Epidemiol. 2017;32:269–287. doi: 10.1007/s10654-017-0243-1.
(30) Dehghan M., Mente A., Zhang X., Swaminathan S., Li W., Mohan V., Iqbal R., Kumar R., Wentzel-Viljoen E., Rosengren A., et al. Associations of fats and carbohydrate intake with cardiovascular disease and mortality in 18 countries from five continents (PURE): A prospective cohort study. Lancet. 2017;391:1679–1680. doi: 10.1016/S0140-6736(17)32252-3.
(31) Phelan M., Kerins D. The potential role of milk-derived peptides in cardiovascular disease. Food Funct. 2011;2:153–167. doi: 10.1039/c1fo10017c
(32) De Goede J., Soedamah-Muthu S.S., Pan A., Gijsbers L., Geleijnse J.M. Dairy consumption and risk of stroke: A systematic review and updated dose-response meta-analysis of prospective cohort studies. J. Am. Heart Assoc. 2016;5:e002787. doi: 10.1161/JAHA.115.002787
(33) Bhat Z.F., Bhat H. Milk and dairy products as functional foods: A review. Int. J. Dairy Sci. 2011;6:1–12. doi: 10.3923/ijds.2011.1.12.
(34) Dunshea F.R., Ostrowska E., Ferrari J.M., Gill H.S. Dairy proteins and the regulation of satiety and obesity. Aust. J. Exp. Agric. 2007;47:1052–1058. doi: 10.1071/EA06263.
(35) Alzamora S.M., Salvatori D., Tapia M.S., López-Malo A., Welti-Chanes J., Fito P. Novel functional foods from vegetable matrices impregnated with biologically active compounds. J. Food Eng. 2005;67:205–214. doi: 10.1016/j.jfoodeng.2004.05.067.
(36) Buttriss J. Nutritional properties of fermented milk products. Int. J. Dairy Technol. 1997;50:21–27. doi: 10.1111/j.1471-0307.1997.tb01731.x.
Literaturverzeichnis
- Nationale Verzehrstudie II, Max Rubner-Institut, Bundesforschungsinstitut für Ernährung und Lebensmittel, 2008
- https://www.hopkinsmedicine.org/health/conditions-and-diseases/thrombosis; aufgerufen am 05.05.2021
- Kimura K, Tomiyama H, Matsumoto C, Odaira M, Shiina K, Nagata M, Yamashina A. Longitudinal changes of the serum calcium levels and accelerated progression of arterial stiffness with age. Atherosclerosis. 2015 Dec;243(2):486-92. doi: 10.1016/j.atherosclerosis.2015.10.002. Epub 2015 Oct 8. PMID: 26520904.
- Walters JR., Calcium channel TRPV6 expression in human duodenum: different relationships to the vitamin D system and aging in men and women. J Bone Miner Res. 2006 Nov;21(11):1770-7. doi: 10.1359/jbmr.060721. PMID: 17002582.
- Zheng W., Critical role of calbindin-D28k in calcium homeostasis revealed by mice lacking both vitamin D receptor and calbindin-D28k. J Biol Chem. 2004 Dec 10;279(50):52406-13. doi: 10.1074/jbc.M405562200. Epub 2004 Sep 29. PMID: 15456794.
- Cavalcoli F, Zilli A, Conte D, Massironi S. Micronutrient deficiencies in patients with chronic atrophic autoimmune gastritis: A review. World J Gastroenterol. 2017 Jan 28;23(4):563-572. doi: 10.3748/wjg.v23.i4.563. PMID: 28216963; PMCID: PMC5292330.
- Wood RJ, Serfaty-Lacrosniere C. Gastric acidity, atrophic gastritis, and calcium absorption. Nutr Rev. 1992 Feb;50(2):33-40. doi: 10.1111/j.1753-4887.1992.tb02510.x. PMID: 1570081.
- Inker LA, Grams ME, Levey AS, et al.; CKD Prognosis Consortium. Relationship of estimated GFR and albuminuria to concurrent laboratory abnormalities: an individual participant data meta-analysis in a global consortium. Am J Kidney Dis. 2019;73(2):206–217. doi:10.1053/j.ajkd.2018.08.013
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD). Kidney Int Suppl (2011). 2017;7(1):1–59. doi:10.1016/j.kisu.2017.04.001
- Isakova T, Nickolas TL, Denburg M, et al. KDOQI US commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD). Am J Kidney Dis. 2017;70(6):737–751. doi:10.1053/j.ajkd.2017.07.019
- Ishitani K, Itakura E, Goto S, Esashi T. Calcium absorption from the ingestion of coral-derived calcium by humans. J Nutr Sci Vitaminol (Tokyo). 1999 Oct;45(5):509-17. doi: 10.3177/jnsv.45.509. PMID: 10683804.
- Hanzlik RP, Fowler SC, Fisher DH. Relative bioavailability of calcium from calcium formate, calcium citrate, and calcium carbonate. J Pharmacol Exp Ther. 2005 Jun;313(3):1217-22. doi: 10.1124/jpet.104.081893. Epub 2005 Feb 25. PMID: 15734899.
- Zijp IM, Korver O, Tijburg LB. Effect of tea and other dietary factors on iron absorption. Crit Rev Food Sci Nutr. 2000 Sep;40(5):371-98. doi: 10.1080/10408690091189194. PMID: 11029010.
- Tsedeke Wolde, Effects of caffeine on health and nutrition: A Review. Food Science and Quality Management. Vol. 30, 2014
- Gupta, Raj Kishor et al. “Reduction of phytic acid and enhancement of bioavailable micronutrients in food grains.” Journal of food science and technology vol. 52,2 (2015): 676-84. doi:10.1007/s13197-013-0978-y
- Kelsay JL. Effects of fiber, phytic acid, and oxalic acid in the diet on mineral bioavailability. Am J Gastroenterol. 1987 Oct;82(10):983-6. PMID: 2821800.
- Deutsche Gesellschaft für Ernährung et al.: Referenzwerte für die Nährstoffzufuhr, 2. Auflage, 3. aktualisierte Ausgabe (2017)
- Deutsche Gesellschaft für Ernährung et al., Die Nährwerttabelle,6 aktualisierte Auflage, 3 (2019/2020)
- Mario J. Soares, Kaveri Pathak, and Emily K. Calton, “Calcium and Vitamin D in the Regulation of Energy Balance: Where Do We Stand?” Int J Mol Sci. 2014 Mar; 15(3): 4938–4945. Mar 20. doi: 10.3390/ijms15034938 PMCID: PMC3975432, PMID: 24658438
- Varsha Narayanan, Shailesh Pallewar, Abhay Mane and Amit Bhargava. A randomized, volunteer, pharmacokinetic study comparing absorption and bioavailability of coral calcium with calcium carbonate and calcium citrate malate supplement. European Journal of Pharmaceutical and Medical Research. 2018, 5(12), 341-345.




